Dərman Vasitələrinin Qeydiyyatı
Şirkət AR-da dərman preparatlarının qeydiyyatı üçün peşəkar xidmətlər təklif edir. Azərbaycan Respublikasının əczaçılıq bazarına satış məqsədi ilə yeni dərman vasitələrinin çıxarılması üçün dövlət qeydiyyatı zəruridir.
Dərman vasitələrinin dövlət qeydiyyatı, təkrar qeydiyyatdan keçirilməsi və qeydiyyat dosyesində olan dəyişikliklərin qeydiyyatı AR Səhiyyə Nazirliyinin Analitik Ekspertiza Mərkəzi (Qurum) tərəfindən həyata keçirilir. Ekspertizanın keçirilmə qaydaları Azərbaycan Respublikası Nazirlər Kabinetinin 25 dekabr 2020-ci il tarixli 502 nömrəli qərarı ilə tənzimlənir.
Dövlət qeydiyyatına alınması zəruri olan dərman vasitələrinin kateqoriyaları aşağıdakılardır:
• orijinal dərman vasitələri;
• generik dərman vasitələri;
• daha əvvəl qeydə alınmış dərman vasitələrinin yeni effektiv kombinasiyaları;
• buraxılış forması və dozası dəyişdirilmiş mövcud qeydiyyatı olan dərman vasitələri.
Dövlət qeydiyyatına alınmayan dərman vasitələri:
• müvafiq resept əsasında və bütün tələbləri yerinə yetirməklə, aptek təşkilatları tərəfindən hazırlanan dərman vasitələri;
• Azərbaycan Respublikasının ərazisindən kənarda alınan və fərdi istifadə üçün nəzərdə tutulan dərman vasitələri.
Dərman Vasitələrinin Qeydiyyat Prosesinin Sxemi
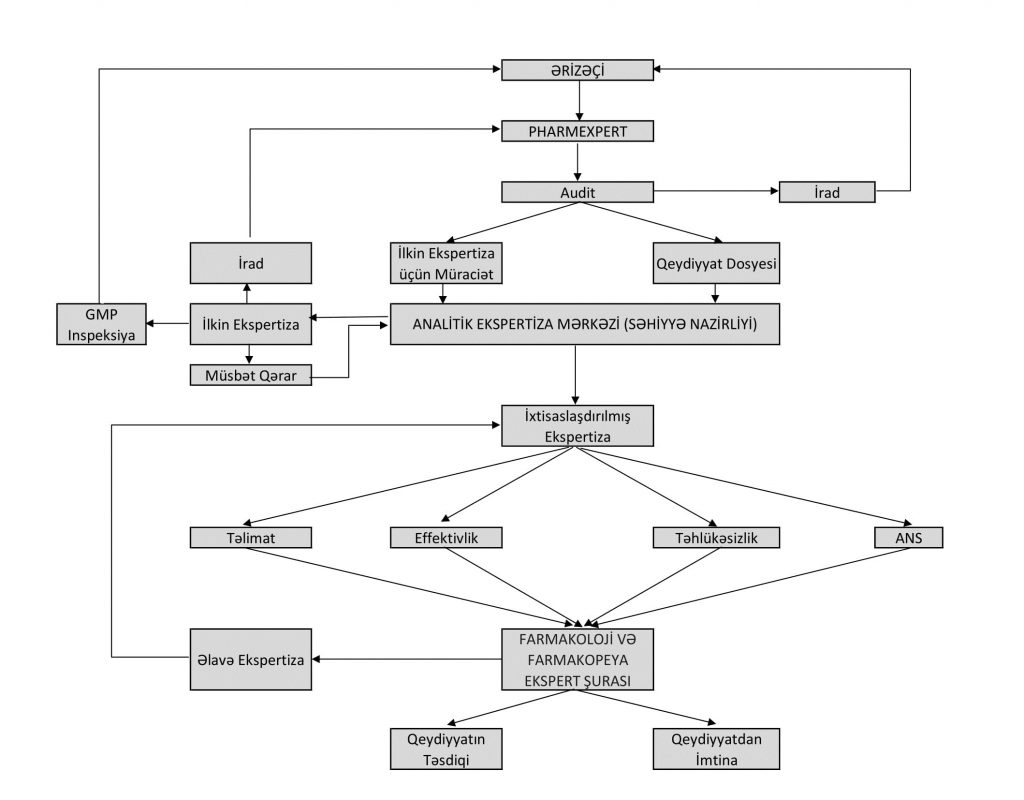
Qeydiyyat prosesi başa çatdıqdan sonra dərman vasitəsi üçün qeydiyyat şəhadətnaməsi verilir və qeydiyyata alınmış dərman vasitəsi dövlət reyestrinə daxil edilir.Yalnız qeydiyyata alındıqdan sonra dərman vasitəsinin respublika ərazisində satışı mümkündür.
Bizim mütəxəssislərə müraciət edərək sənədləşmə prosesində və dövlət qeydiyyat prosedurunda sizə gərəkli olan məsləhət və yardım ala biləriniz. PharmExpert şirkəti yalnız standart qeydiyyat prosedurlarının müşayətini deyil, həmçinin qeydiyyat sənədlərində baş vermiş dəyişikliklərin və dərman vasitələrinin təkrar qeydiyyatdan keçirilməsi xidmətlərini də təqdim edir.
Dərman Vasitələrinin Qeydiyyat Prosesinin İcra Müddəti
(Nazirlər Kabinetinin 2020-ci il 25 Dekabr tarixli 502 nömrəli qərarına uyğun olaraq)
| Prosedurların təsviri | Icra vaxtı |
| Müqavilənin bağlanması (İlkin Ekspertiza) | 5 gün |
| Rüsumun ödənişi (İlkin Ekspertiza) | 15 bank iş günü |
| İlkin Ekspertiza | 15 gün |
| Ərizəçinin ilkin ekspertizada aşkar olunan iradları cavablandırması (əgər mövcuddusa) | 90 gün |
| Müqavilənin bağlanması (İxtisaslaşdırılmış Ekspertiza) | 5 gün |
| Rüsumun ödənişi (İxtisaslaşdırılmış Ekspertiza) | 60 bank iş günü |
| İxtisaslaşdırılmış Ekspertiza | 210 gün |
| İxtisaslaşdırılmış Ekspertiza (Təkrar Qeydiyyat) | 90 gün |
| İxtisaslaşdırılmış Ekspertiza (Dəyişikliyin Qeydiyyatı) | 90 gün |
| Ərizəçinin ixtisaslaşdırılmış ekspertizada aşkar olunan iradları cavablandırması (əgər mövcuddusa) | 90 gün |
| Ekspert Şurasının Qərarı | 10 gün |
| Əlavə İxtisaslaşdırılmış Ekspertiza (ehtiyac olarsa) | 30 gün |
| Ərizəçinin əlavə ixtisaslaşdırılmış ekspertizada aşkar olunan iradları cavablandırması (əgər mövcuddusa) | 90 gün |
| Ekspert Şurasının Yekun Qərarı | 15 gün |
| Qeydiiyat Vəsiqəsinin verilməsi | 15 gün |
Obyektib səbəblərə görə qeydiyyat prosesində gecikmələr yarana bilər. Yuxarıda göstərilən müddətlərə istehsal müəssisənin inspeksiyası daxil deyil.
Bundan əlavə mütəxəssislərimiz sənədləşmə işlərinin və qeydiyyat prosesinin bütün mərhələlərində ortaya çıxan tipik problemləri həll etmək üçün müvafiq tədbirlər sxemi əsasında işləyirlər.
Aşağıdakı hallarda dərman vasitələrinin qeydiyyat sənədlərində baş vermiş dəyişikliləri qeydiyyata salmaq zəruridir:
• dərman vasitəsinin istifadəsinə dair göstərişlərdə yenilənmə;
• dərman vasitəsinin tərkibindəki köməkçi maddələrdə dəyişiklik;
• dərman vasitəsinin istehsal sahəsi üzrə məlumatlar dəyişilərsə;
• dərman vasitəsinin keyfiyyətini xarakterizə edən göstəricilərin, habelə keyfiyyətinə nəzarət metodlarının dəyişdirilməsi;
• qeydiyyatdan keçmiş dərman vasitəsi üçün müəyyən edilmiş son istifadə müddəti dəyişdikdə.
Yuxarıdakı dəyişikliklərin hamısı,istehsalçı tərəfindən dəyişiklik barədə qərar qəbul edildiyi tarixdən etibarən maksimum 3 ay ərzində qeydə alınmalıdır.
Qeydiyyatdan imtina səbəbləri
Səhiyyə Nazirliyi aşağıdakı hallarda dərmanların dövlət qeydiyyatından imtina edir:
• təqdim olunmuş sənədlərdə göstərilən məlumatlar doğru deyilsə;
• dərman vasitəsinin tərkibində Azərbaycan Respublikasının ərazisində qadağan olunmuş maddədən istifadə edilmişdirsə;
• təqdim olunmuş sənədlərdə göstərilən kəmiyyət və keyfiyyət göstəriciləri həqiqətə uyğun deyilsə;
• Əgər terapevtik effektivlik sübut olunmamışdırsa;
• Dərman vasitəsinin təhlükəsizliyi, effektivliyi və keyfiyyətini qiymətləndirən klinik və digər tədqiqatların nəticələri qənaətbəxş olmadıqda;
• qeydiyyat prosesi zamanı ciddi yan təsirlər aşkar edildikdə;
• İstehsal ərazisinin yoxlanılmasının nəticələri haqqında mənfi rəy;
• Azərbaycan Respublikasının Səhiyyə Nazirliyinin Farmakologiya və Farmakopeya üzrə Ekspert Şurası tərəfindən aparılan ixtisaslaşdırılmış ekspertizanın və (və ya) əlavə ixtisaslaşdırılmış ekspertizanın nəticələrinə dair mənfi rəy.
Dərman vasitəsinin dövlət qeydiyyatından imtina barədə qərar qəbul edilərkən ərizəçiyə yazılı halda əsaslı cavab verilir.
Dərman vasitələrinin yenidən qeydiyyatı
Dərman vasitəsinin yenidən dövlət qeydiyyatına alınması məqsədilə ərizəçi
əvvəlki dövlət qeydiyyatının qüvvədəolma müddətinin bitməsinə ən
azı 210 (iki yüz on) təqvim günü qalmış Quruma müraciət etməlidir.
