Регистрация лекарственных средств
Государственная регистрация лекарственных средств является обязательным условием при введении новых препаратов на фармацевтический рынок Азербайджанской Республики.
Компания PHARMEXPERT предлагает вам профессиональные услуги по регистрации лекарственных средств в АР. Государственную регистрацию, перерегистрацию и внесение изменений в регистрационное досье лекарственного средства осуществляет Центр Аналитической Экспертизы при Министерстве Здравоохранении АР. Правила проведения экспертизы регулируются Решением № 502 от 25 декабря 2020 г. Кабинетом Министров Азербайджанской Республики.
Категории лекарственных средств (ЛС), которые подлежат государственной регистрации:
- оригинальные лекарственные средства;
- воспроизведенные лекарственные средства;
- эффективные комбинации лекарственных препаратов, которые были зарегистрированы ранее;
- уже зарегистрированные лекарственные средства, которые изменили выпускаемую лекарственную форму и дозировку.
Лекарственные препараты, которые не подлежат государственной регистрации:
- лекарственные средства, которые были произведены аптечными организациями по соответствующей рецептуре и с выполнением всех требований медицинских организаций;
- лекарственные средства, которые были приобретены за границами территории Азербайджанской Республики и предназначены для личного применения.
Схема Регистрации Лекарственных Средств в Азербайджане
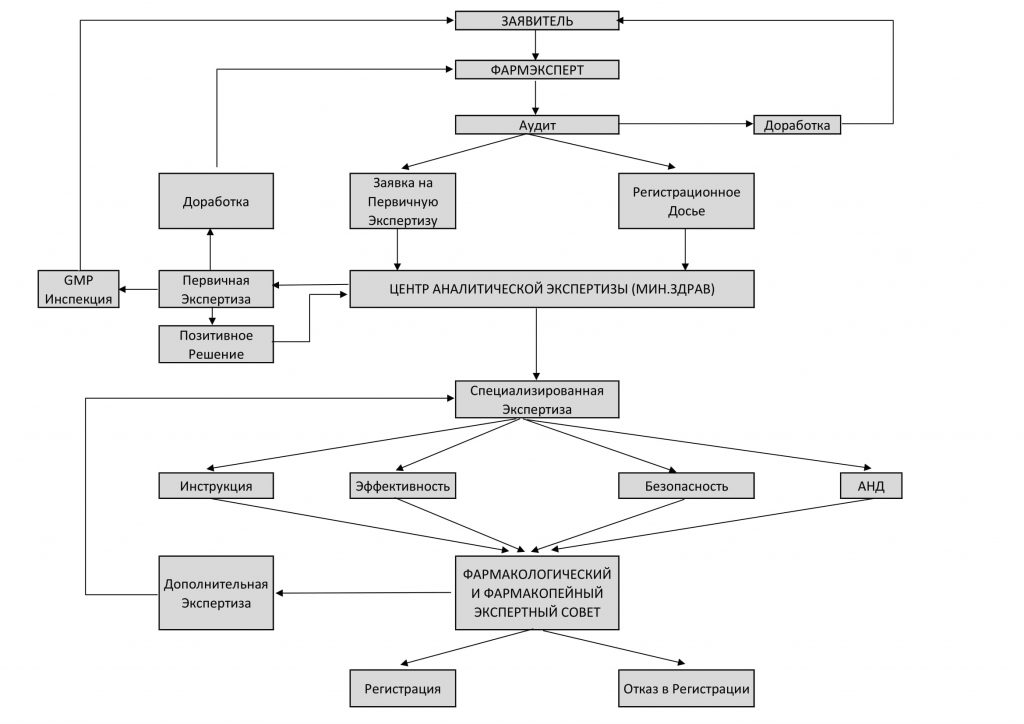
По завершению регистрационного процесса,на лекарственное средство выдается регистрационное удостоверение и зарегистрированное лекарственное средство заносится в государственный реестр.После этого становится возможным реализация лекарственного средства на территории Республики.
Обратившись к нашим специалистам, вы получите квалифицированные советы и помощь в процессе оформления документов и прохождения процедуры государственной регистрации. Мы работаем вплоть до момента получения регистрационного удостоверения на лекарственные средства широкого спектра применения и происхождения, а также инновационные и воспроизведенные препараты.
Сроки Регистрации Лекарственных Средств
Наши специалисты занимаются не только стандартной процедурой регистрации, но и предоставляют услуги по внесению изменений и подтверждению государственной регистрации лекарственных препаратов. Наши сотрудники работают по четко слаженной схеме действий для решения типовых задач и проблем, которые возникают на всех этапах оформления документов и прохождения регистрации.
В соответствии с Решением № 502 от 25 декабря 2020 г. Кабинетом Министров АР
| Описания процедур | Временной интервал |
| Заключение Договора (Первичная Экспертиза) | 5 дней |
| Оплата пошлины (Первичная Экспертиза) | 15 банковских дней |
| Первичная Экспертиза | 15 дней |
| Ответ Заявителя на Замечания Первичной Экспертизы(если имеются) | 90 дней |
| Заключение договора (Специализированная Экспертиза) | 5 дней |
| Оплата пошлины (Специализированная Экспертиза) | 60 дней |
| Специализированная Экспертиза(Регистрация) | 210 дней |
| Специализированная Экспертиза (при Перерегистрации) | 90 дней |
| Специализированная Экспертиза (при Внесении Изменений) | 90 дней |
| Ответ Заявителя на Замечания Специализированной Экспертизы (если имеется) | 90 дней |
| Заключение Экспертного Совета | 10 дней |
| Дополнительная Специализированная Экспертиза(при необходимости) | 30 дней |
| Ответ Заявителя на Замечания Дополнительной Специализированной Экспертизы (если имеются) | 90 дней |
| Окончательное Заключение Экспертного Совета | 15 дней |
| Получение Регистрационного Удостоверения | 15 дней |
По объективным причинам в процессе регистрации могут быть опоздания.Вышеуказанный период регистрации не включают сроки проведения инспекции производственной площадки.
Изменения, которые требуют проведения экспертизы:
- при необходимости изменить инструкцию по применению лекарственного средства
- включение дополнительных сведений к составу лекарственного препарата;
- при внесении изменений в данные о месте производства лекарственного средства для медицинского использования;
- при изменении показателей, которые характеризуют качество лекарственного препарата, а также при замене способов контроля качества препарата;
- при изменении срока годности, установленного для зарегистрированного лекарственного средства.
Все вышеуказанные изменения должны быть зарегистрированы максимум в течении 3 месяцев со дня принятия решения производителся об изменении.
Причины для отказа в регистрации;
Министерство Здравоохранения отказывает в государственной регистрации лекарственных средств в следующих случаях:
- Если информация, указанная в предоставленных документах, не соответствует действительности;
- В составе лекарственного средства находится запрещенное на территории Азербайджанской Республики вещество;
- Если количественные и качественные показатели, указанные в представленных документах, не соответствуют действительности;
- Если терапевтическая эффективность не доказана;
- Клинические испытания и другие исследования по оценке безопасности, эффективности и качества лекарственного средства неудовлетворительные.
- При обнаружении серьезных побочных эффектов в процессе регистрации;
- Отрицательное мнение о результатах проверки производителя;
- Отрицательное мнение о результатах специализированной экспертизы и (или) о результатах дополнительной специализированной экспертизы, проведенной Экспертным Советом по Фармакологии и Фармакопее Министерства здравоохранения Азербайджанской Республики.
При принятии решения об отказе в государственной регистрации лекарственного средства заявителю предоставляется письменный обоснованный ответ.
Сроки перерегистрации.
Согласно законодательству, в целях перерегистрации лекарственного средства заявитель должен обратиться в Орган не позднее, чем за 210 (двести десять) календарных дней до окончания срока действия прежней государственной регистрации.
